过程控制及设备
郭肖杰1,2,王立言3,张翀1,2,4,邢新会1,2,4,5
1 清华大学 化学工程学系
2 工业生物催化教育部重点实验室
3 清华大学 无锡应用技术研究院
4 清华大学 合成与系统生物学中心
5 清华大学 深圳国际研究生院生物医药与健康工程研究院
摘要:液滴微流控由于可以快速生成大量微液滴,并实现单个液滴独立的控制,每个液滴都可以作为独立的单元进行微生物培养,因此在微生物的高通量培养方面具有独特的应用优势。然而现有研究多停留在实验室搭建和使用阶段,存在操作要求高、影响因素多、缺乏自动化集成技术等关键问题,制约了液滴微流控技术在微生物研究中的应用。文中以解决液滴微流控技术用于微生物培养的装备化问题为目标,系统研究了微流控各单元模块的结构与功能,通过对液滴的发生、培养、检测、分割、融合、分选等多种操作的开发与集成,成功研制出了小型一体化、全自动高通量的微生物微液滴培养 (Microbial Microdroplet Culture system,MMC) 装备系统,可用于微生物的生长曲线测定、适应性进化、单因素多水平分析及代谢物检测等,为面向微生物菌种高效选育的进化培养和筛选提供了高通量仪器平台。
微生物培养是微生物科学研究和工业应用领域的重要基础,广泛应用于微生物的分离、鉴定、分析、筛选、驯化、适应性进化、菌株改造等方面[1-3]。然而,传统微生物培养方法主要以试管、摇瓶、固体平板为培养容器,辅以摇床、分光光度计、酶标仪等设备进行微生物的培养、检测和筛选,存在操作繁琐、效率低、耗时、耗力、耗物等问题。近年发展起来的高通量培养手段主要是以微孔板为容器建立起来的培养筛选体系,但微孔板一方面溶氧水平低,混合效果差、蒸发效应和热效应比较严重,常常导致菌种生长状况差,且差异性大[1,4-6];另一方面需要配套昂贵的设备,如移液工作站、酶标仪等,才能实现自动化培养和过程检测。
液滴微流控作为微流控技术的重要分支,是近年来在传统连续流微流控系统基础上发展起来的,利用互不相溶的两液相产生分散的微液滴并对微液滴进行操作的非连续流微流控技术[7]。微液滴具有体积小、比表面积大,独立无交叉污染等特点,再结合液滴可控性强、通量高等优势,已经有研究将其用于微生物的高通量培养[8]、驯化[9]、筛选[10-12]等方面,展现出重要的应用潜力。然而,液滴微流控从实验室技术走向应用推广仍然存在一系列关键问题。首先,液滴微流控操作繁琐精细,技术要求和门槛高;其次,液滴微流控技术涉及光、机、电的元部件联合使用,且需要和生物技术应用场景结合,如果没有多学科交叉协作,一般单个实验室或团队难以搭建高效的液滴微流控系统,从而无法开展液滴在微生物技术中的广泛应用研究;再次,由于液滴体积极小 (皮升–微升),面向微生物传代、进化和分选的等基本操作的自动化液滴精确操控与实时在线检测实现难度大,难以形成一体化装备系统[13]。为解决液滴微流控技术在微生物研究中应用推广的关键问题,笔者团队开展了一系列应用基础和工程转化研究工作,成功地开发了一款基于液滴微流控技术的全自动高通量微生物微液滴培养系统 (Microbial microdroplet culture system,MMC)。该系统包含液滴识别模块、液滴光谱检测模块、微流控芯片模块、进样模块等多个功能模块,通过上述模块的系统集成和控制,精确地建立了液滴的发生、培养、监测 (细胞光密度 (Optical density,OD) 和荧光)、分割、融合、分选等系列单元的自动化操作体系,从而成功地实现了微生物液滴培养过程需要的接种、培养、监测、传代、筛选等功能的集成化。MMC系统中每个液滴体积为2–3 μL,可以容纳高达200个液滴培养单元,相当于200个摇瓶培养当量。该微液滴培养体系能保证微生物生长过程中的无染菌性、溶氧、混合和质能交换等需求,通过光谱检测指标对微液滴内的微生物可进行传代、多梯度化学因子添加、提取等系列操作,满足微生物研究的多种需求,比如生长曲线测定、适应性进化、单因素多水平分析、代谢物研究 (荧光检测法) 等。
在液滴微流控系统中,对每个液滴的快速正确识别是对微液滴进行精准操作的前提。Jakiela等采用机器视觉方法,通过摄像机对芯片进行图像采集,利用其开发的“边缘识别”算法,实现对芯片内微液滴的精确识别[9]。但该方法需要光源照明,会严重干扰本研究中的光谱信号检测,同时所需配套设备较为昂贵复杂,不易实施,因此需要开发一种快速简易的油水识别系统,并且不对光谱信号采集产生干扰。液滴微流控系统中的水相和油相均为无色透明液体 (水相可能会因为内容物的变化而出现颜色浊度的变化),光吸收度几乎相同,基于光吸收原理的普通的光电检测系统则无法进行精确识别。考虑到油水两相的光反射率和折射率不同,本研究提出并设计了如下的光电检测系统 (图1):激光以一定的角度斜射至芯片通道检测窗口处,光电探测器置于芯片微通道下方,油相和水相流经该检测窗口处时,由于两者的光反射率和折射率不同,造成光的反射和折射具有较大差异,因此进入光电探测器的光强会产生较大变化,转化输出的电信号具有明显特征,进而实现液滴的快速精确识别。

图1 液滴识别系统示意图
Fig. 1 Schematic diagram of droplet identification device.
微生物培养过程需要连续监测微生物细胞浓度 (OD) 及底物和代谢产物的变化,以便深入研究其生长和代谢特性。MMC系统中液滴的体积小 (2–3 μL) ,并且全封闭运行,无法取样检测,同时对于生长量较大的微生物更无法进行稀释处理。这就需要一个能够实时在线、大量程的光学检测系统,且易于操作并具有经济性。已报道文献多采用两种方法进行OD检测,一种是将光纤集成于芯片之中,位于通道两侧,当液滴经过时进行检测[9],这个方法对芯片工艺要求较高,芯片制造成本必然会大大增加。另一种方法则采用图像采集,然后进行灰度分析以获取近似的OD数据[14]。但该方法难以对复杂的光谱信号进行分段检测,同时可检测范围有限,影响因素多。为解决上述问题,本研究在微流控芯片的实时在线检测模块开发中,设计了一种基于光纤的新型短光程光谱检测系统 (图2):该系统将光纤与芯片分离,置于芯片两侧,光纤与光源和检测器连接,构成光谱检测通路,微液滴流经芯片的检测窗口处时,其光谱信号被检测器读取和转换,转换信号反馈给上位机进行记录和分析,并匹配到对应编号的液滴中,然后显示在控制软件界面上。这种检测方式操作简单、实时在线检测、稳定性高,并且对芯片制造工艺要求较低,加工成本大幅度降低。
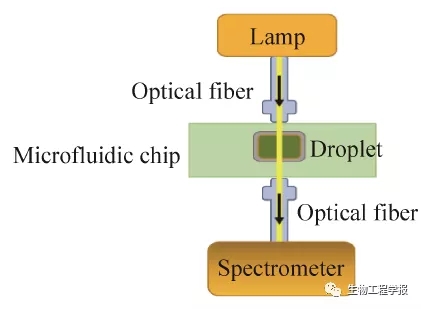
图2 液滴光谱信号检测示意图
Fig. 2 Schematic diagram of droplet spectrum signal device.
在传统微流控操作过程中,通常通过两种方式将样品引入至芯片。一种是利用注射泵和注射器,先用注射器抽取样品,然后安装至注射泵,通过注射泵推动注射器将样品导入芯片。这种进样方式需要对注射器以及注射泵阀头进行清洗和灭菌,在使用过程中反复拆装,操作繁琐,操作难度大,且染菌风险高[14]。另一种则是利用基于气体介质的压力泵,先将样品放置在密闭瓶子 中,通过压力泵对瓶内压力的控制,将样品泵入芯 片[9]。这种进样方式虽然简单,但极易受系统压力的波动影响,无法精准定量操作。MMC是面向微生物技术应用开发的自动化进化培养装备,上述两种传统操作方式均不能满足本研究的需求,因此,如何开发出既能够简单精确导入样品,又能够便于清洗灭菌的进样系统成为MMC进样技术的关键所在。为此,本研究创造性地将传统的两种进样方式进行了结合,既利用了注射泵进样的精确性,又利用了压力泵进样的便捷性。本研究设计的MMC进样系统如图3所示:该系统由油相、注射泵、进样瓶组成,其核心是进样瓶 的设计,进样瓶顶部有两个管口,中间管口用于油相的进出,侧面管口则用于水相的进出。注射泵通过顶部管口,推动油相进入进样瓶,因为MMC所用的油相密度低于水相,且油相和水相互不相溶,两相在进样瓶中形成稳定的分层状态,进而油相会驱动等体积的水相从进样瓶的侧面管口流出并进入芯片,达到定量向芯片进样的目的。该设计可避免水相物质流经注射器、阀等装置,无需清洗,操作简便安全。同时该系统的组装操作可在超净台中独立完成,能够有效地规避染菌风险,满足后续微生物培养的需求。
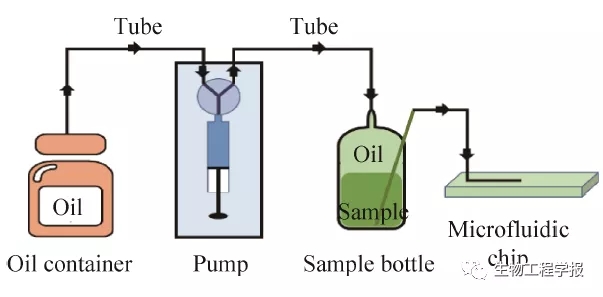
图3 进样系统设计示意图
Fig. 3 Schematic diagram of sample injection system.
1.4.1 液滴发生
基于微流控芯片的液滴发生技术常见的有3种,分别为流动聚焦法、十字通道法、T形通道法[13],并且常常通过调节油相和水相的进样流速来控制生成液滴的大小。但由于芯片加工通常存在批次间误差以及水相粘度差异等问题,不同芯片往往需要调整油相和水相的流速参数,才能形成稳定的微液滴,这些问题一直是微流控芯片应用于微生物培养的关键技术挑战。如何低成本地设计能够兼容芯片批次间误差和样品粘度差异等实际情况,且可以高精度地对液滴进行操作的芯片系统成为关键。考虑到T形通道结构简单易加工、成本较低,本研究将该结构引入芯片设计中。为了克服芯片批次误差和样品粘度差异等问题,本研究一反常规液滴微流控的连续进样方式,发明了独特的油相和水相间歇顺次驱动进样方法,进而在芯片中生成体积大小精确可控的微液滴 (图4A),并通过巧妙串联使用T形结构通道,可以生成浓度梯度不同且精确可控的微液滴 (图4B)。
1.4.2 液滴培养
微生物培养过程通常需要提供合适的温度、氧气等条件。基于微流控的好氧微生物培养,常常用透气性良好的PDMS作为芯片材质,辅以环境温度控制,来满足微生物的生长需求[15]。但是PDMS具有柔性较大、易形变等特点,给液滴的精确稳定操作带来了极大的负面影响,所以不适合用于本研究。因此,如何既能够实现液滴培养的气体交换,又具备良好刚性和光学性能的芯片系统成为微生物微液滴培养的关键。而从目前已开发的芯片材质分析,透气性和刚性往往不可兼得。为此,本研究提出了将液滴操作和液滴培养两个过程分离的思路,即利用刚性强、光学性能优的材料加工微流控芯片,利用透气性强、变形性小的微管路作为液滴培养的容器,实现硬质芯片与透气培养管路的有机结合,成功解决了微生物微液滴培养的难题。液滴在系统运行过程中,不断往复于培养管路之中,进而充分满足培养过程中气体交换的需求。
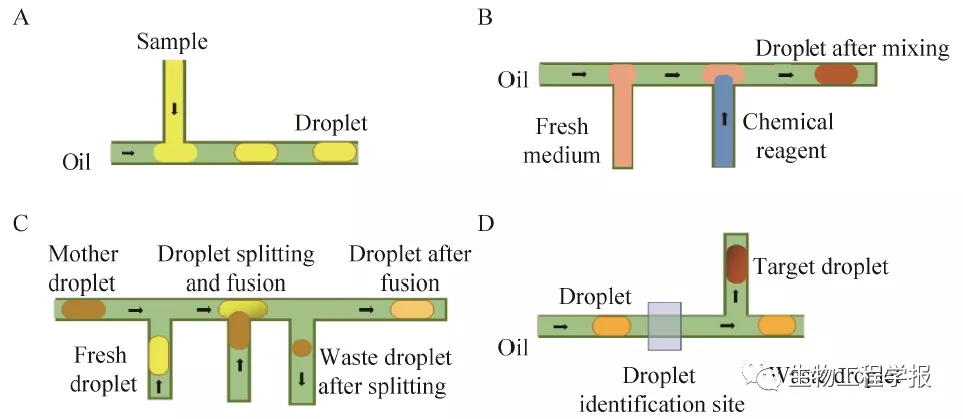
图4 液滴操作系统:(A:液滴发生;B:多浓度梯度液滴发生;C:液滴分割融合;D:液滴分选)
Fig. 4 Droplet operation system. (A) Droplet generation. (B) Droplet of multi-level concentration gradient generation. (C) Droplet spitting and fusion. (D) Droplet sorting.
1.4.3 液滴分割融合
微生物的传代培养操作中,需要将培养到一定阶段的菌悬液取出一部分,接种到新培养基中,继续进行传代培养。在本研究需要实现将已培养的微生物微液滴向新培养基液滴中接种菌液,实现基于微液滴的微生物传代培养操作。传统的液滴分割融合方式常常利用芯片结构对已培养的所有母液滴进行分割,生成两个子液滴,其中一个子液滴则直接从废液口排出,待所有液滴完成分割后,再将所有待利用的子液滴与新培养基液滴进行融合,从而完成液滴的微生物传代[9]。但在对已培养的母液滴进行分割处理中,往往存在液滴的识别和驱动过程误差,造成液滴切割融合的精确性下降,而长期多次操作会进一步导致单次操作误差的累积,造成最终的液滴体积差异过大,稳定性差等问题。另外,如果分割后的子液滴体积较小,则其在往复运动过程中容易发生相互融合,影响系统稳定性。如何能够精确实现液滴分割融合操作、避免误差累积、降低液滴之间融合风险、提高系统运行稳定性成为液滴传代操作的关键。为解决液滴分割融合误差的问题,本研究创造性地提出“掐头去尾”式的液滴分割融合新方法 (图4C),即液滴经过识别点时,液滴体积的大部分停留在注入通道中,通过推动主通道中油相流动,对驻留液滴暴露在主通道中的小部分头部体积部分进行切割,将液滴分割成两部分,头部液滴部分被推入废液通道,另一部分则停留在驻留通道中;此时,将新培养基液滴推动至液滴注入通道口处,然后将被切割液滴定量进入新液滴,再次推动融合后的液滴离开注入通道口,而残余的液滴尾部则也被推入至废液中。同时,这种巧妙的液滴操作方式,使得液滴的分割和融合过程紧密相连,避免了小体积液滴长时间运行而可能造成的相互融合,极大提高了微液滴系统运行的稳定性。
1.4.4 液滴分选
液滴从生成开始,通过液滴识别系统对每个液滴进行编号,每个液滴的所有检测数据都会与对应编号的液滴进行匹配,因此在分选操作实施前,液滴经过识别点进行编号识别,根据培养过程微液滴OD检测数据,如果是所需液滴,就会通过阀口,收集至收集管中,如果是废弃液滴则被推入下游管路,继续下一个液滴的分选处理 (图4D),进而实现目标微生物微液滴的分选。
1.4.5 芯片集成化设计
在实现微液滴发生、培养、分割融合、监测、分选的基础之上,本研究对这些功能结构进行了系统集成,形成了功能完备的集成化微流控芯片系统 (图5)。其中2号、4号、6号与进样瓶相连,分别用以盛放种子液、新鲜培养基、化学因子母液。1号、3号、5号均是油相通道,直接与注射泵相连。1号、3号管路为长度为2 m的透气性良好的AF-2400材质管路 (内径=1 mm,外径=1.6 mm)[16],液滴在两者之间进行往复运动。废液管与阀相连,用以排出废液。芯片中的液滴识别点、光谱检测点则分别作为液滴识别窗口和光谱检测窗口。芯片系统整体置于恒温控制仓中,保证微生物培养提供所需的最适温度。
在上述各模块功能基础上,通过光机电一体化结构设计,对各功能模块进行集成和控制系统开发,实现了微生物微液滴的自动发生、往复培养、在线监测、分割、融合、分选等功能的有序操作,整机结构设计如图6所示:卤素灯和光谱仪作为光学检测的功能元件,通过光纤连接至芯片检测窗口处,对运行中的液滴进行光谱数据采集和分析;阀和注射泵组协调联动,构成整机动力模块;芯片系统和进样瓶均分布在操作仓中,并通过加热片对其进行恒温控制;油相瓶和废液瓶分别盛放油相试剂和废液。
多部件的协调控制是实现装备自动化运行的关键,本研究研制了用于MMC自动化操作的软件控制系统 (图7)。通过在金属浴模块、操作仓温控模块、液滴识别模块中分别设置温度传感器1、温度传感器2、光电传感器,可以将这些传感器所采集数据通过底层通讯协议传输给基于行调ARM单片机开发的下位机控制系统。下位机系统将所收集的数据与上位机系统发送的数据进行对比,然后对金属浴模块中的加热器1、操作仓温控模块的加热器2、液滴识别系统中的激光器进控。泵阀组与光谱仪作为第三方元部件,其本身拥有自身的驱动控制板,通过通讯协议,可直接接受上位机软件的控制进行精确工作。
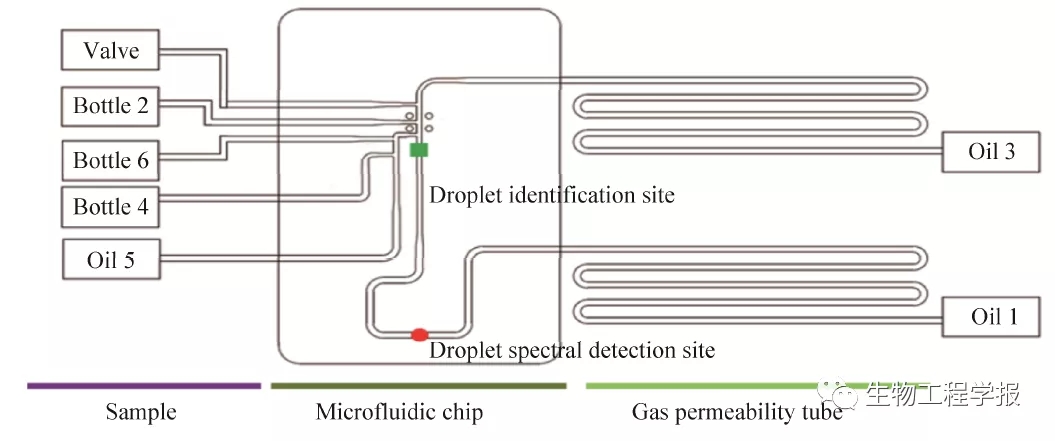
图5 集成化微流控芯片系统结构示意图
Fig. 5 Structure diagram of integrated microfluidic chip system.
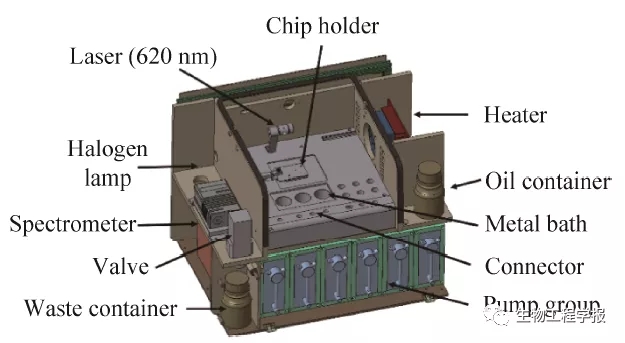
图6 集成化设备结构示意图
Fig. 6 Schematic diagram of integrated equipment structure.
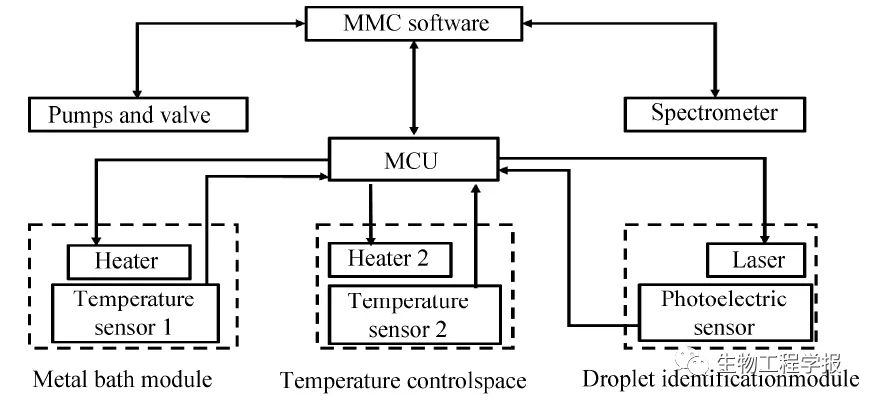
图7 MMC自动化运行控制系统框架图
Fig. 7 MMC automatic control system frame.
MMC系统可以将液滴的发生、培养、监测、分割、融合、分选等复杂过程进行自由组合,形成不同运行逻辑,进而适于多种多样的微生物应用研究。本研究基于MMC设备进行了微生物的生长曲线测定、单因素多水平实验、适应性进化实验、代谢研究等多种应用展示。
MMC所用的注射泵购于帝肯 (CavroXcalibur Pump);电磁阀 (Mrv-01) 购于润泽流体;卤素光源 (HL2000) 和光谱仪 (EQ2000) 购于上海辰昶仪器设备有限公司;激光器购于华上激光科技有限公司;亚克力板和微管路 (AF-2400材质) 均购于上海尚久橡塑制品厂;SMA905光纤购于深圳鑫瑞光技术有限公司;紫外-可见光分光光度计 (721G型号) 购于上海仪电分析仪器有限公司;台式恒温摇床 (THZ-D) 购于苏州硕舟科技有限公司。
实验中所用菌种为大肠杆菌Escherichia coli MG1655,含绿色荧光蛋白 (Green fluorescent protein,GFP) 表达质粒;所用培养基为LB培养基 (成分:蛋白胨0.5 g,酵母提取物0.25 g,氯化钠0.5 g,加水50 mL);矿物油 (含表面活性剂span 80,浓度为10 g/L) 购自Sigma-Aldrich;单硫酸卡那霉素 (兽用) 购自山东鲁西兽药。
大肠杆菌种子液制备:从平板上挑取大肠杆菌E. coli MG1655菌落接种至LB培养基中,在37 ℃、220 r/min摇床条件下活化培养3–4 h。
大肠杆菌在MMC中培养过程:取大肠杆菌种子液,按照5%的接种量接种至含5 mL培养基的15 mL离心管中混匀,然后转移至MMC进样瓶中进行上机实验,MMC中培养温度设定为37 ℃,根据不同的需求和条件,设定MMC的软件系统进行培养。
大肠杆菌分光光度计检测方法:取大肠杆菌悬液稀释至OD600在0.2–0.8之间,使用分光光度计测定OD600值,并根据稀释倍数计算原始样品OD600值。
将波长为620 nm的半导体激光器照射在液滴识别窗口处,入射角从0°逐渐增大至接近90°,观察液滴和油相经过检测窗口处时光电压值大小 (图8A)。通过实验发现,当入射角为36°时,液滴经过检测窗口的光电压信号值可以稳定大于3 V,而此时油相的光电压信号值则稳定小于0.6 V (图8B),据此可以将油相和液滴进行精确的区分,每个液滴的识别时间小于0.3 s,从而实现了液滴的快速精确识别。且该系统结构简单、运行稳定、易批量化搭建。
芯片检测窗口处通道深度为1 mm,所以对应的光吸收度检测光程约为1 mm,这区别于常规标准比色皿所使用的1 cm光程,由于测量光程的大幅度减小,OD的线性范围和可检测量程得到了大幅度提高。通过对大肠杆菌的离心处理,获得高浓度的菌悬液,将该悬液进行梯度稀释,并同时用传统的紫外-可见光分光光度计和MMC的OD直接检测系统 (无稀释) 进行比较测试 (图9)。通过实验发现,MMC的OD直接检测量程达到30,检测灵敏度为0.05,此外,MMC直接测得的OD值与基于稀释法的分光光度计检测OD值在0–20之间成良好的线性关系。并且与传统的OD检测方式的频繁取样和稀释操作相比,MMC具有无需取样、无需稀释、实时在线检测等多种显著优势,有利于实现MMC的自动化操作。
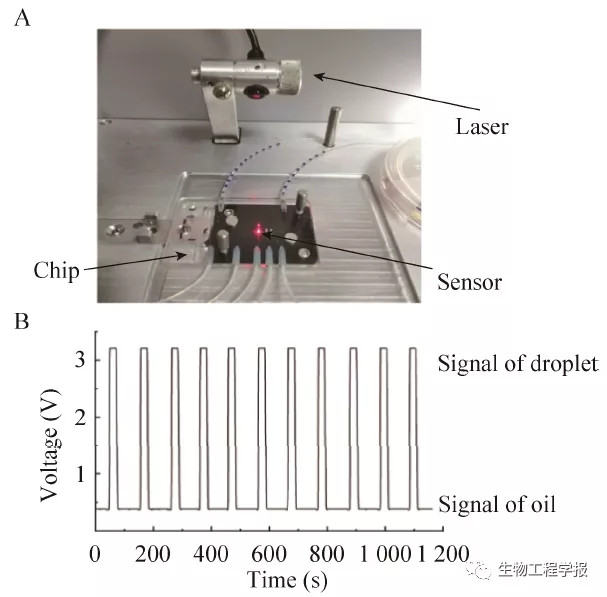
图8 液滴识别系统 (A:装置实物图;B:液滴和油相的电压信号值)
Fig. 8 Droplet identification system on chip. (A) Image of chip for detection. (B) Detected signal of droplet and oil.
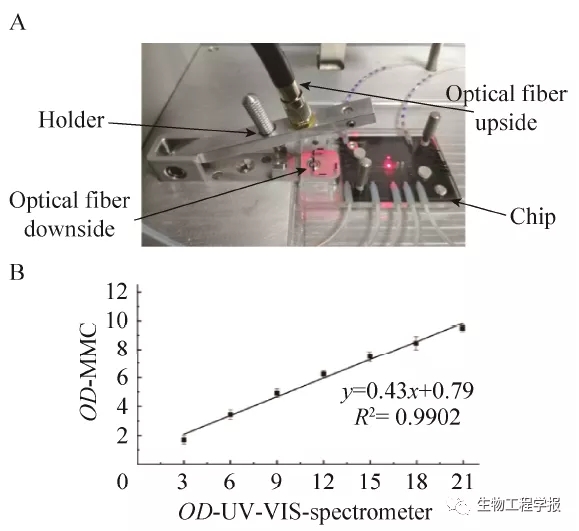
图9 液滴光谱检测 (A:液滴光谱信号检测装置图;B:MMC和分光光度计的中OD600检测数据对比)
Fig. 9 Droplet spectral detection. (A) Photo of droplet OD measurement set. (B) Calibration curves for OD measured by UV-VIS-spectrometer and MMC detection.
进样瓶是向芯片稳定精确进样、无菌控制的关键。由于进样瓶的原理是等体积的油驱动等体积的水相样品进入芯片,因此进样瓶内不允许有气泡存在,否则由于气泡的可压缩性过大,会严重影响进样的精确性。为了保证进样瓶装样时空气的完全排除,无气泡残留,本研究将瓶帽设计于瓶子底部,而进样瓶内顶部则采用圆弧形设计,便于瓶内气泡的充分排出 (图10)。在操作过程中,我们首先在超净台内将样品加入到瓶子中,并补充油相至瓶子完全充满,由于密度不同,在瓶子中油相位于上层而水相位于下层,装完样品后,将进样瓶中间的油相出入口接口插入侧边的水相出入口中,形成密封,防止转移过程中造成样品污染,从超净台拿出后,将其与芯片和仪器进行连接,水相出口 (Sample outlet) 与芯片连接,油相入口 (Oil inlet) 与MMC仪器接口连接,通过注射泵推动油相即可实现定量驱动水相进入芯片。这种方式不仅避免了样品染菌风险,同时操作简便、极易清洗灭菌,大大提高了仪器的操作简便性。
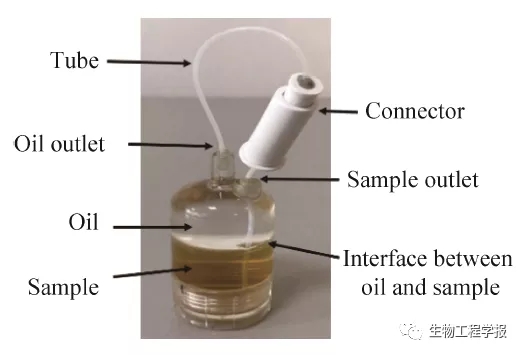
图10 进入芯片形成液滴的进样瓶实物照片
Fig. 10 Photo of sample bottle flowing into chip to make droplets.
经过多次实验测试,本研究最终选用聚甲基丙烯酸甲酯 (Polymeric methyl methacrylate, PMMA) 材质进行芯片加工,该材质具有光学性能好、易加工键合、刚性较好等特点。标准芯片通道深度和宽度均为1 mm (图11A) 。与芯片连接的管路采用AF-2400材质,该管路透气性好,可以满足多数微生物的气体交换 (图11B) 。液滴的生成、切割融合、分选、检测均在芯片中进行,而液滴的培养则是在管路中进行。油相和水相样品一端通过管路与芯片连通,另一端则与注射泵连通。芯片上分布有液滴操作的相关流道以及用于液滴识别和检测的窗口。
通过对MMC系统各个功能模块的光机电结构一体化设计及集成,最终形成了商业化应用设备 (图12A)。MMC系统操作仓室内部采用恒温控制,芯片和样品均放置在操作仓中。油相试剂放置在油相试剂仓室,运行过程中产生的废液则排放至放置在废液瓶仓室的废液瓶中。MMC仪器下侧的注射泵仓室中放置仪器所使用的6台工业注射泵。在恒温操作仓室内部 (图12B),紫外灯为仓室进行照射灭菌处理,进样瓶放置于金属浴中,可以快速升温并保持稳定,避免瓶子热胀冷缩对进样精度造成的影响,为方便液滴收集,设计EP管支架于仓室内。

图11 芯片系统实物图 (A:MMC微流控芯片实物图;B:MMC培养管路实物图)
Fig. 11 Photo of microfluidic chip system. (A) MMC microfluidic chip. (B) MMC culture tube.

图12 MMC实物图 (A:MMC外观;B:恒温仓室内部结构图)
Fig. 12 Photo of MMC. (A) The exterior of MMC. (B) Internal image of temperature control space in MMC.
在本项目所研制的MMC装备上,本研究分别进行了大肠杆菌的生长曲线测定、适应性进化实验、单因素多水平实验以及微生物代谢水平检测实验。在这些实验中,均采用培养至对数期的大肠杆菌作为种子液,以5%接种量接种至进样瓶中,设置OD检测波长为600 nm。各实验根据不同需求设置不同的液滴生成数量,每轮实验开始前,均需要对设备及芯片进行初始化运行,然后开始进入正式实验,各实验结果如下。
3.6.1 生长曲线测定
生长曲线测定实验是研究微生物生长状况的基本实验。在设备初始化完成后,选取软件中“生长曲线测定”功能,设置液滴数量为20,点击“运行”,28 h后导出液滴培养数据并进行处理。本研究对20个液滴的生长数据进行平均值和标准差分析,绘制出大肠杆菌的生长曲线,结果如图13A 所示:生长曲线程“S”形,且20个液滴生长一致性良好,各液滴之间的OD值变异系数小于5%,充分说明了该设备良好的微生物培养和检测性能。
3.6.2 适应性进化研究
在在微生物的适应性进化研究中,常常需要在对微生物进行持续传代的过程中,逐渐提高耐受因子的浓度。本实验中,以氯化钠作为耐受因子,选取MMC操作软件中“适应性进化”模块,设置液滴数目为30,每传代3次,将氯化钠 (NaCl) 浓度提高到一个新的水平,持续传代驯化,获得的进化培养结果如图13B所示:图中具有周期性的峰形曲线代表微生物的每一代生长曲线,而峰谷则代表在该时间点处进行了微生物的传代操作,OD值会骤然下降,红色折线则代表对应培养时间下液滴培养单元中的盐浓度,其梯度浓度由小到大依次为11 g/L、11.5 g/L、12 g/L、12.5 g/L,每个浓度梯度下进行3次大肠杆菌的连续传代培养 (共20 h),然后提升到更高的浓度梯度继续传代驯化。该驯化过程共进行80 h,随着盐浓度的逐渐提升,大肠杆菌的生长速率和OD最大值逐渐下降,但每批传代液滴里的微生物均能生长,并且随着进化进行,液滴间OD逐渐呈现出差异变化。该实验过程充分体现了适应性进化的基本实验策略,即在长期的传代培养过程中,通过逐渐提高耐受性因子水平,以进化出菌种的耐受性。由于MMC的液滴培养单元仅为2 μL,试剂消耗量极少,而进样瓶可以一次性盛放12 mL的样品,因此单次上机操作能够满足多达150次的连续传代培养。同时,如图13B所示,MMC中的每个液滴代表独立进化培养单元,MMC的在线检测功能可以为微生物进化培养过程提供海量数据,因此结合MMC的底物和代谢产物检测功能及后续多组学分析方法,能够对微生物进化过程进行系统深入的分析。
3.6.3 单因素多水平实验
单因素多水平实验是在常规微生物实验中,用以测定某个化学因子对微生物生长状态的影响。本实验中以单硫酸卡那霉素作为化学因子,研究其对大肠杆菌生长的影响。样品上机后,选 取软件中“单因素多水平功能”,设置参数为:梯 度个数8,每个梯度平行单元 (液滴) 数10个,启动设备运行功能即可。结果如图13C所示:图中不同颜色曲线代表不同的单硫酸卡纳霉素培养条件下大肠杆菌生长情况,每条曲线都是根据在单个梯度下,对10个平行微液滴单元的OD检测值进行统计处理得到的结果。从图中可以看出,随着单硫酸卡纳霉素的浓度增加,大肠杆菌的生长受抑制情况越来越严重。相对于传统在线检测设备,MMC的OD检测线性范围宽 (0–20),可以将微生物生长过程完整地记录下来,能够更加便捷地研究化学因子对菌种生长的影响规律。
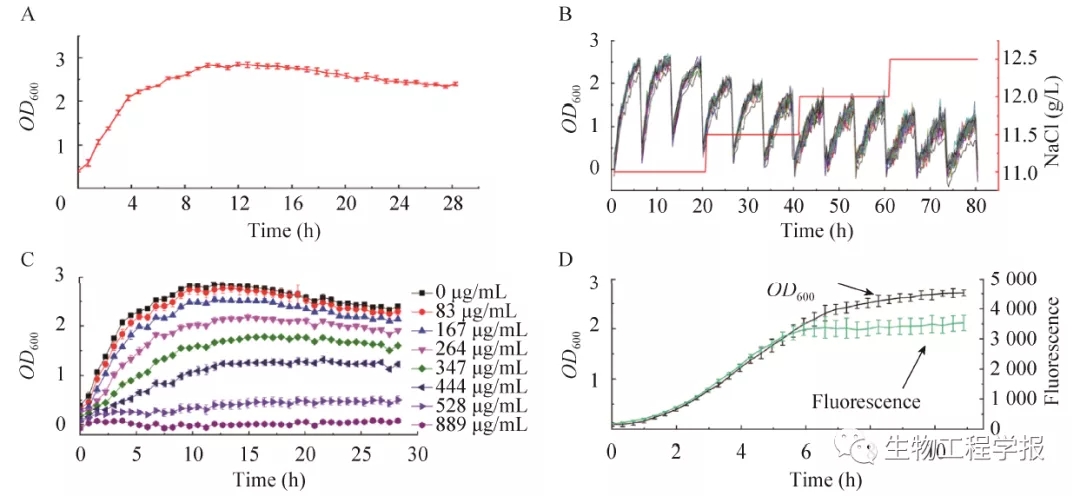
图13 MMC在大肠杆菌培养中的应用 (A:生长曲线测定;B:以氯化钠为进化压力的菌株适应性进化;C:单硫酸卡那霉素对大肠杆菌生长的单因素多水平影响实验;D:MMC中菌株代谢检测 (GFP荧光检测))
Fig. 13 Use of MMC in E. coli culture. (A) Growth curve test. (B) Adaptive laboratory evolution experiment using NaCl as the selective pressure. (C) Single-factor experiment for bacterial growth with addition of kanamycin monosulfate at different concentrations. (D) Online monitoring of bacterial metabolism in terms of GFP fluorescence during the cell growth in MMC.
3.6.4 微生物代谢水平研究
微生物代谢水平常可以通过荧光信号来检测表征,本研究利用的大肠杆菌含有GFP基因,其荧光信号强度变化可反映微生物的代谢状态变化。选取MMC软件中“荧光检测”功能模块,设置荧光激发与检测波段为 (485ex/528em,即激发波长485 nm,发射波长528 nm),液滴数目为10,结果如图13D所示。图中的黑色曲线代表大肠杆菌OD值变化,绿色曲线是GFP荧光值变化。从图13D可以看出,随着大肠杆菌的生长,其GFP荧光信号强度也在逐渐增加,表明GFP的合成与细胞生长偶联,而培养到达平台期后,GFP荧光强度基本保持不变,表明蛋白合成结束。MMC这种在线快速检测荧光的方式,结合微生物生长曲线的在线检测和进化培养及分选功能等,对于能够合成自身具有荧光的代谢产物的微生物及以荧光蛋白作为分子标记的基因工程菌的代谢特性研究具有平台支撑作用。
除了上述4种典型的微生物实验和微生物筛选外,MMC还可以根据使用者的自身需求,支持自定义编程多种功能,设置不同的液滴操作流程,以满足各种实验需要[17]。同时,已有的研究结果也表明,MMC可应用于多种微生物的培养研究,表现出明显优于孔板的应用成效,具有广谱适用性[18]。
液滴微流控技术因生成的液滴体积小、通量高、质能交换快、可独立操作等特性为微生物研究提供了新方法,但其操作要求高、影响因素多、缺乏自动化集成等问题限制了该技术的应用推广。本研究针对上述关键难题,通过设计开发液滴识别功能模块、液滴检测模块、进样模块以及芯片模块等,将液滴的发生、培养、检测、分割、融合、分选等多种复杂操作进行有机集成,成功研制出了一款全自动高通量微生物微液滴培养系统 (MMC),形成了小型化、自动化、高通量的微生物培养系统,并且操作简单,运行稳定。相比于传统的微生物高通量培养装备,MMC具有物料消耗少、操作简单、在线检测 (OD和荧光)、数据采集密度大、普适性强等多种优势。
目前,本研究已经完成了MMC系统底层单元操作的开发,未来需要针对微生物研究的不同需求,进一步丰富MMC系统应用功能,例如开发多因素多水平正交实验功能,多样品自动进样技术用以同时测定多个菌种的生长曲线,液滴内氧分压和pH等参数的精确控制等,全面助推微生物培养进入高通量智能化的微滴时代。
通讯作者1

主持国家自然科学基金重大仪器专项项目、中以国际合作项目。发表学术论文280余篇,合作著书8本,编写英文专著1部,译著教材2部。申请发明专利100余项,获得发明专利80余项。担任Biochemical Engineering Journal副主编及《生物工程学报》等多个国内外学术期刊编委。获得第17届全国发明展览会奖银奖 (2007)、北京市科学技术奖三等奖 (2008)、中国石油和化学工业协会技术发明奖二等奖 (2009)、中国侨界贡献奖 (创新人才) (2010)、高等学校科学研究优秀成果奖 (科学技术) 科技进步奖 二等奖 (2015年)、 第45届日内瓦国际发明展金奖 (2017)、中国化工学会系统2012–2017年度先进个人 (2017)、全国归侨侨眷先进个人 (2018)、日本东京大学工学院会士 (Fellow) 荣誉称号 (2018) 中国轻工业联合会技术发明一等奖 (2019)。
通讯作者2

主持国家自然科学基金项目、国家重点研发计划课题。在Nature Chemical Biology、Nucleic Acids Research、Metabolic Engineering等学术期刊发表多篇论文。担任中国生物发酵产业协会微生物育种分会秘书长、Carbon Resources、Food Science and Human Wellness等期刊编委。获得中国轻工业联合会技术发明一等奖 (2019)、“长江学者奖励计划”青年学者 (2018)、“伦世仪教育基金”杰出青年学者奖 (2018)、第45届日内瓦国际发明展金奖 (2017)。
·END·
过程控制及设备
郭肖杰1,2,王立言3,张翀1,2,4,邢新会1,2,4,5
1 清华大学 化学工程学系
2 工业生物催化教育部重点实验室
3 清华大学 无锡应用技术研究院
4 清华大学 合成与系统生物学中心
5 清华大学 深圳国际研究生院生物医药与健康工程研究院
摘要:液滴微流控由于可以快速生成大量微液滴,并实现单个液滴独立的控制,每个液滴都可以作为独立的单元进行微生物培养,因此在微生物的高通量培养方面具有独特的应用优势。然而现有研究多停留在实验室搭建和使用阶段,存在操作要求高、影响因素多、缺乏自动化集成技术等关键问题,制约了液滴微流控技术在微生物研究中的应用。文中以解决液滴微流控技术用于微生物培养的装备化问题为目标,系统研究了微流控各单元模块的结构与功能,通过对液滴的发生、培养、检测、分割、融合、分选等多种操作的开发与集成,成功研制出了小型一体化、全自动高通量的微生物微液滴培养 (Microbial Microdroplet Culture system,MMC) 装备系统,可用于微生物的生长曲线测定、适应性进化、单因素多水平分析及代谢物检测等,为面向微生物菌种高效选育的进化培养和筛选提供了高通量仪器平台。
微生物培养是微生物科学研究和工业应用领域的重要基础,广泛应用于微生物的分离、鉴定、分析、筛选、驯化、适应性进化、菌株改造等方面[1-3]。然而,传统微生物培养方法主要以试管、摇瓶、固体平板为培养容器,辅以摇床、分光光度计、酶标仪等设备进行微生物的培养、检测和筛选,存在操作繁琐、效率低、耗时、耗力、耗物等问题。近年发展起来的高通量培养手段主要是以微孔板为容器建立起来的培养筛选体系,但微孔板一方面溶氧水平低,混合效果差、蒸发效应和热效应比较严重,常常导致菌种生长状况差,且差异性大[1,4-6];另一方面需要配套昂贵的设备,如移液工作站、酶标仪等,才能实现自动化培养和过程检测。
液滴微流控作为微流控技术的重要分支,是近年来在传统连续流微流控系统基础上发展起来的,利用互不相溶的两液相产生分散的微液滴并对微液滴进行操作的非连续流微流控技术[7]。微液滴具有体积小、比表面积大,独立无交叉污染等特点,再结合液滴可控性强、通量高等优势,已经有研究将其用于微生物的高通量培养[8]、驯化[9]、筛选[10-12]等方面,展现出重要的应用潜力。然而,液滴微流控从实验室技术走向应用推广仍然存在一系列关键问题。首先,液滴微流控操作繁琐精细,技术要求和门槛高;其次,液滴微流控技术涉及光、机、电的元部件联合使用,且需要和生物技术应用场景结合,如果没有多学科交叉协作,一般单个实验室或团队难以搭建高效的液滴微流控系统,从而无法开展液滴在微生物技术中的广泛应用研究;再次,由于液滴体积极小 (皮升–微升),面向微生物传代、进化和分选的等基本操作的自动化液滴精确操控与实时在线检测实现难度大,难以形成一体化装备系统[13]。为解决液滴微流控技术在微生物研究中应用推广的关键问题,笔者团队开展了一系列应用基础和工程转化研究工作,成功地开发了一款基于液滴微流控技术的全自动高通量微生物微液滴培养系统 (Microbial microdroplet culture system,MMC)。该系统包含液滴识别模块、液滴光谱检测模块、微流控芯片模块、进样模块等多个功能模块,通过上述模块的系统集成和控制,精确地建立了液滴的发生、培养、监测 (细胞光密度 (Optical density,OD) 和荧光)、分割、融合、分选等系列单元的自动化操作体系,从而成功地实现了微生物液滴培养过程需要的接种、培养、监测、传代、筛选等功能的集成化。MMC系统中每个液滴体积为2–3 μL,可以容纳高达200个液滴培养单元,相当于200个摇瓶培养当量。该微液滴培养体系能保证微生物生长过程中的无染菌性、溶氧、混合和质能交换等需求,通过光谱检测指标对微液滴内的微生物可进行传代、多梯度化学因子添加、提取等系列操作,满足微生物研究的多种需求,比如生长曲线测定、适应性进化、单因素多水平分析、代谢物研究 (荧光检测法) 等。
在液滴微流控系统中,对每个液滴的快速正确识别是对微液滴进行精准操作的前提。Jakiela等采用机器视觉方法,通过摄像机对芯片进行图像采集,利用其开发的“边缘识别”算法,实现对芯片内微液滴的精确识别[9]。但该方法需要光源照明,会严重干扰本研究中的光谱信号检测,同时所需配套设备较为昂贵复杂,不易实施,因此需要开发一种快速简易的油水识别系统,并且不对光谱信号采集产生干扰。液滴微流控系统中的水相和油相均为无色透明液体 (水相可能会因为内容物的变化而出现颜色浊度的变化),光吸收度几乎相同,基于光吸收原理的普通的光电检测系统则无法进行精确识别。考虑到油水两相的光反射率和折射率不同,本研究提出并设计了如下的光电检测系统 (图1):激光以一定的角度斜射至芯片通道检测窗口处,光电探测器置于芯片微通道下方,油相和水相流经该检测窗口处时,由于两者的光反射率和折射率不同,造成光的反射和折射具有较大差异,因此进入光电探测器的光强会产生较大变化,转化输出的电信号具有明显特征,进而实现液滴的快速精确识别。

图1 液滴识别系统示意图
Fig. 1 Schematic diagram of droplet identification device.
微生物培养过程需要连续监测微生物细胞浓度 (OD) 及底物和代谢产物的变化,以便深入研究其生长和代谢特性。MMC系统中液滴的体积小 (2–3 μL) ,并且全封闭运行,无法取样检测,同时对于生长量较大的微生物更无法进行稀释处理。这就需要一个能够实时在线、大量程的光学检测系统,且易于操作并具有经济性。已报道文献多采用两种方法进行OD检测,一种是将光纤集成于芯片之中,位于通道两侧,当液滴经过时进行检测[9],这个方法对芯片工艺要求较高,芯片制造成本必然会大大增加。另一种方法则采用图像采集,然后进行灰度分析以获取近似的OD数据[14]。但该方法难以对复杂的光谱信号进行分段检测,同时可检测范围有限,影响因素多。为解决上述问题,本研究在微流控芯片的实时在线检测模块开发中,设计了一种基于光纤的新型短光程光谱检测系统 (图2):该系统将光纤与芯片分离,置于芯片两侧,光纤与光源和检测器连接,构成光谱检测通路,微液滴流经芯片的检测窗口处时,其光谱信号被检测器读取和转换,转换信号反馈给上位机进行记录和分析,并匹配到对应编号的液滴中,然后显示在控制软件界面上。这种检测方式操作简单、实时在线检测、稳定性高,并且对芯片制造工艺要求较低,加工成本大幅度降低。

图2 液滴光谱信号检测示意图
Fig. 2 Schematic diagram of droplet spectrum signal device.
在传统微流控操作过程中,通常通过两种方式将样品引入至芯片。一种是利用注射泵和注射器,先用注射器抽取样品,然后安装至注射泵,通过注射泵推动注射器将样品导入芯片。这种进样方式需要对注射器以及注射泵阀头进行清洗和灭菌,在使用过程中反复拆装,操作繁琐,操作难度大,且染菌风险高[14]。另一种则是利用基于气体介质的压力泵,先将样品放置在密闭瓶子 中,通过压力泵对瓶内压力的控制,将样品泵入芯 片[9]。这种进样方式虽然简单,但极易受系统压力的波动影响,无法精准定量操作。MMC是面向微生物技术应用开发的自动化进化培养装备,上述两种传统操作方式均不能满足本研究的需求,因此,如何开发出既能够简单精确导入样品,又能够便于清洗灭菌的进样系统成为MMC进样技术的关键所在。为此,本研究创造性地将传统的两种进样方式进行了结合,既利用了注射泵进样的精确性,又利用了压力泵进样的便捷性。本研究设计的MMC进样系统如图3所示:该系统由油相、注射泵、进样瓶组成,其核心是进样瓶 的设计,进样瓶顶部有两个管口,中间管口用于油相的进出,侧面管口则用于水相的进出。注射泵通过顶部管口,推动油相进入进样瓶,因为MMC所用的油相密度低于水相,且油相和水相互不相溶,两相在进样瓶中形成稳定的分层状态,进而油相会驱动等体积的水相从进样瓶的侧面管口流出并进入芯片,达到定量向芯片进样的目的。该设计可避免水相物质流经注射器、阀等装置,无需清洗,操作简便安全。同时该系统的组装操作可在超净台中独立完成,能够有效地规避染菌风险,满足后续微生物培养的需求。

图3 进样系统设计示意图
Fig. 3 Schematic diagram of sample injection system.
1.4.1 液滴发生
基于微流控芯片的液滴发生技术常见的有3种,分别为流动聚焦法、十字通道法、T形通道法[13],并且常常通过调节油相和水相的进样流速来控制生成液滴的大小。但由于芯片加工通常存在批次间误差以及水相粘度差异等问题,不同芯片往往需要调整油相和水相的流速参数,才能形成稳定的微液滴,这些问题一直是微流控芯片应用于微生物培养的关键技术挑战。如何低成本地设计能够兼容芯片批次间误差和样品粘度差异等实际情况,且可以高精度地对液滴进行操作的芯片系统成为关键。考虑到T形通道结构简单易加工、成本较低,本研究将该结构引入芯片设计中。为了克服芯片批次误差和样品粘度差异等问题,本研究一反常规液滴微流控的连续进样方式,发明了独特的油相和水相间歇顺次驱动进样方法,进而在芯片中生成体积大小精确可控的微液滴 (图4A),并通过巧妙串联使用T形结构通道,可以生成浓度梯度不同且精确可控的微液滴 (图4B)。
1.4.2 液滴培养
微生物培养过程通常需要提供合适的温度、氧气等条件。基于微流控的好氧微生物培养,常常用透气性良好的PDMS作为芯片材质,辅以环境温度控制,来满足微生物的生长需求[15]。但是PDMS具有柔性较大、易形变等特点,给液滴的精确稳定操作带来了极大的负面影响,所以不适合用于本研究。因此,如何既能够实现液滴培养的气体交换,又具备良好刚性和光学性能的芯片系统成为微生物微液滴培养的关键。而从目前已开发的芯片材质分析,透气性和刚性往往不可兼得。为此,本研究提出了将液滴操作和液滴培养两个过程分离的思路,即利用刚性强、光学性能优的材料加工微流控芯片,利用透气性强、变形性小的微管路作为液滴培养的容器,实现硬质芯片与透气培养管路的有机结合,成功解决了微生物微液滴培养的难题。液滴在系统运行过程中,不断往复于培养管路之中,进而充分满足培养过程中气体交换的需求。

图4 液滴操作系统:(A:液滴发生;B:多浓度梯度液滴发生;C:液滴分割融合;D:液滴分选)
Fig. 4 Droplet operation system. (A) Droplet generation. (B) Droplet of multi-level concentration gradient generation. (C) Droplet spitting and fusion. (D) Droplet sorting.
1.4.3 液滴分割融合
微生物的传代培养操作中,需要将培养到一定阶段的菌悬液取出一部分,接种到新培养基中,继续进行传代培养。在本研究需要实现将已培养的微生物微液滴向新培养基液滴中接种菌液,实现基于微液滴的微生物传代培养操作。传统的液滴分割融合方式常常利用芯片结构对已培养的所有母液滴进行分割,生成两个子液滴,其中一个子液滴则直接从废液口排出,待所有液滴完成分割后,再将所有待利用的子液滴与新培养基液滴进行融合,从而完成液滴的微生物传代[9]。但在对已培养的母液滴进行分割处理中,往往存在液滴的识别和驱动过程误差,造成液滴切割融合的精确性下降,而长期多次操作会进一步导致单次操作误差的累积,造成最终的液滴体积差异过大,稳定性差等问题。另外,如果分割后的子液滴体积较小,则其在往复运动过程中容易发生相互融合,影响系统稳定性。如何能够精确实现液滴分割融合操作、避免误差累积、降低液滴之间融合风险、提高系统运行稳定性成为液滴传代操作的关键。为解决液滴分割融合误差的问题,本研究创造性地提出“掐头去尾”式的液滴分割融合新方法 (图4C),即液滴经过识别点时,液滴体积的大部分停留在注入通道中,通过推动主通道中油相流动,对驻留液滴暴露在主通道中的小部分头部体积部分进行切割,将液滴分割成两部分,头部液滴部分被推入废液通道,另一部分则停留在驻留通道中;此时,将新培养基液滴推动至液滴注入通道口处,然后将被切割液滴定量进入新液滴,再次推动融合后的液滴离开注入通道口,而残余的液滴尾部则也被推入至废液中。同时,这种巧妙的液滴操作方式,使得液滴的分割和融合过程紧密相连,避免了小体积液滴长时间运行而可能造成的相互融合,极大提高了微液滴系统运行的稳定性。
1.4.4 液滴分选
液滴从生成开始,通过液滴识别系统对每个液滴进行编号,每个液滴的所有检测数据都会与对应编号的液滴进行匹配,因此在分选操作实施前,液滴经过识别点进行编号识别,根据培养过程微液滴OD检测数据,如果是所需液滴,就会通过阀口,收集至收集管中,如果是废弃液滴则被推入下游管路,继续下一个液滴的分选处理 (图4D),进而实现目标微生物微液滴的分选。
1.4.5 芯片集成化设计
在实现微液滴发生、培养、分割融合、监测、分选的基础之上,本研究对这些功能结构进行了系统集成,形成了功能完备的集成化微流控芯片系统 (图5)。其中2号、4号、6号与进样瓶相连,分别用以盛放种子液、新鲜培养基、化学因子母液。1号、3号、5号均是油相通道,直接与注射泵相连。1号、3号管路为长度为2 m的透气性良好的AF-2400材质管路 (内径=1 mm,外径=1.6 mm)[16],液滴在两者之间进行往复运动。废液管与阀相连,用以排出废液。芯片中的液滴识别点、光谱检测点则分别作为液滴识别窗口和光谱检测窗口。芯片系统整体置于恒温控制仓中,保证微生物培养提供所需的最适温度。
在上述各模块功能基础上,通过光机电一体化结构设计,对各功能模块进行集成和控制系统开发,实现了微生物微液滴的自动发生、往复培养、在线监测、分割、融合、分选等功能的有序操作,整机结构设计如图6所示:卤素灯和光谱仪作为光学检测的功能元件,通过光纤连接至芯片检测窗口处,对运行中的液滴进行光谱数据采集和分析;阀和注射泵组协调联动,构成整机动力模块;芯片系统和进样瓶均分布在操作仓中,并通过加热片对其进行恒温控制;油相瓶和废液瓶分别盛放油相试剂和废液。
多部件的协调控制是实现装备自动化运行的关键,本研究研制了用于MMC自动化操作的软件控制系统 (图7)。通过在金属浴模块、操作仓温控模块、液滴识别模块中分别设置温度传感器1、温度传感器2、光电传感器,可以将这些传感器所采集数据通过底层通讯协议传输给基于行调ARM单片机开发的下位机控制系统。下位机系统将所收集的数据与上位机系统发送的数据进行对比,然后对金属浴模块中的加热器1、操作仓温控模块的加热器2、液滴识别系统中的激光器进控。泵阀组与光谱仪作为第三方元部件,其本身拥有自身的驱动控制板,通过通讯协议,可直接接受上位机软件的控制进行精确工作。

图5 集成化微流控芯片系统结构示意图
Fig. 5 Structure diagram of integrated microfluidic chip system.

图6 集成化设备结构示意图
Fig. 6 Schematic diagram of integrated equipment structure.

图7 MMC自动化运行控制系统框架图
Fig. 7 MMC automatic control system frame.
MMC系统可以将液滴的发生、培养、监测、分割、融合、分选等复杂过程进行自由组合,形成不同运行逻辑,进而适于多种多样的微生物应用研究。本研究基于MMC设备进行了微生物的生长曲线测定、单因素多水平实验、适应性进化实验、代谢研究等多种应用展示。
MMC所用的注射泵购于帝肯 (CavroXcalibur Pump);电磁阀 (Mrv-01) 购于润泽流体;卤素光源 (HL2000) 和光谱仪 (EQ2000) 购于上海辰昶仪器设备有限公司;激光器购于华上激光科技有限公司;亚克力板和微管路 (AF-2400材质) 均购于上海尚久橡塑制品厂;SMA905光纤购于深圳鑫瑞光技术有限公司;紫外-可见光分光光度计 (721G型号) 购于上海仪电分析仪器有限公司;台式恒温摇床 (THZ-D) 购于苏州硕舟科技有限公司。
实验中所用菌种为大肠杆菌Escherichia coli MG1655,含绿色荧光蛋白 (Green fluorescent protein,GFP) 表达质粒;所用培养基为LB培养基 (成分:蛋白胨0.5 g,酵母提取物0.25 g,氯化钠0.5 g,加水50 mL);矿物油 (含表面活性剂span 80,浓度为10 g/L) 购自Sigma-Aldrich;单硫酸卡那霉素 (兽用) 购自山东鲁西兽药。
大肠杆菌种子液制备:从平板上挑取大肠杆菌E. coli MG1655菌落接种至LB培养基中,在37 ℃、220 r/min摇床条件下活化培养3–4 h。
大肠杆菌在MMC中培养过程:取大肠杆菌种子液,按照5%的接种量接种至含5 mL培养基的15 mL离心管中混匀,然后转移至MMC进样瓶中进行上机实验,MMC中培养温度设定为37 ℃,根据不同的需求和条件,设定MMC的软件系统进行培养。
大肠杆菌分光光度计检测方法:取大肠杆菌悬液稀释至OD600在0.2–0.8之间,使用分光光度计测定OD600值,并根据稀释倍数计算原始样品OD600值。
将波长为620 nm的半导体激光器照射在液滴识别窗口处,入射角从0°逐渐增大至接近90°,观察液滴和油相经过检测窗口处时光电压值大小 (图8A)。通过实验发现,当入射角为36°时,液滴经过检测窗口的光电压信号值可以稳定大于3 V,而此时油相的光电压信号值则稳定小于0.6 V (图8B),据此可以将油相和液滴进行精确的区分,每个液滴的识别时间小于0.3 s,从而实现了液滴的快速精确识别。且该系统结构简单、运行稳定、易批量化搭建。
芯片检测窗口处通道深度为1 mm,所以对应的光吸收度检测光程约为1 mm,这区别于常规标准比色皿所使用的1 cm光程,由于测量光程的大幅度减小,OD的线性范围和可检测量程得到了大幅度提高。通过对大肠杆菌的离心处理,获得高浓度的菌悬液,将该悬液进行梯度稀释,并同时用传统的紫外-可见光分光光度计和MMC的OD直接检测系统 (无稀释) 进行比较测试 (图9)。通过实验发现,MMC的OD直接检测量程达到30,检测灵敏度为0.05,此外,MMC直接测得的OD值与基于稀释法的分光光度计检测OD值在0–20之间成良好的线性关系。并且与传统的OD检测方式的频繁取样和稀释操作相比,MMC具有无需取样、无需稀释、实时在线检测等多种显著优势,有利于实现MMC的自动化操作。

图8 液滴识别系统 (A:装置实物图;B:液滴和油相的电压信号值)
Fig. 8 Droplet identification system on chip. (A) Image of chip for detection. (B) Detected signal of droplet and oil.

图9 液滴光谱检测 (A:液滴光谱信号检测装置图;B:MMC和分光光度计的中OD600检测数据对比)
Fig. 9 Droplet spectral detection. (A) Photo of droplet OD measurement set. (B) Calibration curves for OD measured by UV-VIS-spectrometer and MMC detection.
进样瓶是向芯片稳定精确进样、无菌控制的关键。由于进样瓶的原理是等体积的油驱动等体积的水相样品进入芯片,因此进样瓶内不允许有气泡存在,否则由于气泡的可压缩性过大,会严重影响进样的精确性。为了保证进样瓶装样时空气的完全排除,无气泡残留,本研究将瓶帽设计于瓶子底部,而进样瓶内顶部则采用圆弧形设计,便于瓶内气泡的充分排出 (图10)。在操作过程中,我们首先在超净台内将样品加入到瓶子中,并补充油相至瓶子完全充满,由于密度不同,在瓶子中油相位于上层而水相位于下层,装完样品后,将进样瓶中间的油相出入口接口插入侧边的水相出入口中,形成密封,防止转移过程中造成样品污染,从超净台拿出后,将其与芯片和仪器进行连接,水相出口 (Sample outlet) 与芯片连接,油相入口 (Oil inlet) 与MMC仪器接口连接,通过注射泵推动油相即可实现定量驱动水相进入芯片。这种方式不仅避免了样品染菌风险,同时操作简便、极易清洗灭菌,大大提高了仪器的操作简便性。

图10 进入芯片形成液滴的进样瓶实物照片
Fig. 10 Photo of sample bottle flowing into chip to make droplets.
经过多次实验测试,本研究最终选用聚甲基丙烯酸甲酯 (Polymeric methyl methacrylate, PMMA) 材质进行芯片加工,该材质具有光学性能好、易加工键合、刚性较好等特点。标准芯片通道深度和宽度均为1 mm (图11A) 。与芯片连接的管路采用AF-2400材质,该管路透气性好,可以满足多数微生物的气体交换 (图11B) 。液滴的生成、切割融合、分选、检测均在芯片中进行,而液滴的培养则是在管路中进行。油相和水相样品一端通过管路与芯片连通,另一端则与注射泵连通。芯片上分布有液滴操作的相关流道以及用于液滴识别和检测的窗口。
通过对MMC系统各个功能模块的光机电结构一体化设计及集成,最终形成了商业化应用设备 (图12A)。MMC系统操作仓室内部采用恒温控制,芯片和样品均放置在操作仓中。油相试剂放置在油相试剂仓室,运行过程中产生的废液则排放至放置在废液瓶仓室的废液瓶中。MMC仪器下侧的注射泵仓室中放置仪器所使用的6台工业注射泵。在恒温操作仓室内部 (图12B),紫外灯为仓室进行照射灭菌处理,进样瓶放置于金属浴中,可以快速升温并保持稳定,避免瓶子热胀冷缩对进样精度造成的影响,为方便液滴收集,设计EP管支架于仓室内。

图11 芯片系统实物图 (A:MMC微流控芯片实物图;B:MMC培养管路实物图)
Fig. 11 Photo of microfluidic chip system. (A) MMC microfluidic chip. (B) MMC culture tube.

图12 MMC实物图 (A:MMC外观;B:恒温仓室内部结构图)
Fig. 12 Photo of MMC. (A) The exterior of MMC. (B) Internal image of temperature control space in MMC.
在本项目所研制的MMC装备上,本研究分别进行了大肠杆菌的生长曲线测定、适应性进化实验、单因素多水平实验以及微生物代谢水平检测实验。在这些实验中,均采用培养至对数期的大肠杆菌作为种子液,以5%接种量接种至进样瓶中,设置OD检测波长为600 nm。各实验根据不同需求设置不同的液滴生成数量,每轮实验开始前,均需要对设备及芯片进行初始化运行,然后开始进入正式实验,各实验结果如下。
3.6.1 生长曲线测定
生长曲线测定实验是研究微生物生长状况的基本实验。在设备初始化完成后,选取软件中“生长曲线测定”功能,设置液滴数量为20,点击“运行”,28 h后导出液滴培养数据并进行处理。本研究对20个液滴的生长数据进行平均值和标准差分析,绘制出大肠杆菌的生长曲线,结果如图13A 所示:生长曲线程“S”形,且20个液滴生长一致性良好,各液滴之间的OD值变异系数小于5%,充分说明了该设备良好的微生物培养和检测性能。
3.6.2 适应性进化研究
在在微生物的适应性进化研究中,常常需要在对微生物进行持续传代的过程中,逐渐提高耐受因子的浓度。本实验中,以氯化钠作为耐受因子,选取MMC操作软件中“适应性进化”模块,设置液滴数目为30,每传代3次,将氯化钠 (NaCl) 浓度提高到一个新的水平,持续传代驯化,获得的进化培养结果如图13B所示:图中具有周期性的峰形曲线代表微生物的每一代生长曲线,而峰谷则代表在该时间点处进行了微生物的传代操作,OD值会骤然下降,红色折线则代表对应培养时间下液滴培养单元中的盐浓度,其梯度浓度由小到大依次为11 g/L、11.5 g/L、12 g/L、12.5 g/L,每个浓度梯度下进行3次大肠杆菌的连续传代培养 (共20 h),然后提升到更高的浓度梯度继续传代驯化。该驯化过程共进行80 h,随着盐浓度的逐渐提升,大肠杆菌的生长速率和OD最大值逐渐下降,但每批传代液滴里的微生物均能生长,并且随着进化进行,液滴间OD逐渐呈现出差异变化。该实验过程充分体现了适应性进化的基本实验策略,即在长期的传代培养过程中,通过逐渐提高耐受性因子水平,以进化出菌种的耐受性。由于MMC的液滴培养单元仅为2 μL,试剂消耗量极少,而进样瓶可以一次性盛放12 mL的样品,因此单次上机操作能够满足多达150次的连续传代培养。同时,如图13B所示,MMC中的每个液滴代表独立进化培养单元,MMC的在线检测功能可以为微生物进化培养过程提供海量数据,因此结合MMC的底物和代谢产物检测功能及后续多组学分析方法,能够对微生物进化过程进行系统深入的分析。
3.6.3 单因素多水平实验
单因素多水平实验是在常规微生物实验中,用以测定某个化学因子对微生物生长状态的影响。本实验中以单硫酸卡那霉素作为化学因子,研究其对大肠杆菌生长的影响。样品上机后,选 取软件中“单因素多水平功能”,设置参数为:梯 度个数8,每个梯度平行单元 (液滴) 数10个,启动设备运行功能即可。结果如图13C所示:图中不同颜色曲线代表不同的单硫酸卡纳霉素培养条件下大肠杆菌生长情况,每条曲线都是根据在单个梯度下,对10个平行微液滴单元的OD检测值进行统计处理得到的结果。从图中可以看出,随着单硫酸卡纳霉素的浓度增加,大肠杆菌的生长受抑制情况越来越严重。相对于传统在线检测设备,MMC的OD检测线性范围宽 (0–20),可以将微生物生长过程完整地记录下来,能够更加便捷地研究化学因子对菌种生长的影响规律。

图13 MMC在大肠杆菌培养中的应用 (A:生长曲线测定;B:以氯化钠为进化压力的菌株适应性进化;C:单硫酸卡那霉素对大肠杆菌生长的单因素多水平影响实验;D:MMC中菌株代谢检测 (GFP荧光检测))
Fig. 13 Use of MMC in E. coli culture. (A) Growth curve test. (B) Adaptive laboratory evolution experiment using NaCl as the selective pressure. (C) Single-factor experiment for bacterial growth with addition of kanamycin monosulfate at different concentrations. (D) Online monitoring of bacterial metabolism in terms of GFP fluorescence during the cell growth in MMC.
3.6.4 微生物代谢水平研究
微生物代谢水平常可以通过荧光信号来检测表征,本研究利用的大肠杆菌含有GFP基因,其荧光信号强度变化可反映微生物的代谢状态变化。选取MMC软件中“荧光检测”功能模块,设置荧光激发与检测波段为 (485ex/528em,即激发波长485 nm,发射波长528 nm),液滴数目为10,结果如图13D所示。图中的黑色曲线代表大肠杆菌OD值变化,绿色曲线是GFP荧光值变化。从图13D可以看出,随着大肠杆菌的生长,其GFP荧光信号强度也在逐渐增加,表明GFP的合成与细胞生长偶联,而培养到达平台期后,GFP荧光强度基本保持不变,表明蛋白合成结束。MMC这种在线快速检测荧光的方式,结合微生物生长曲线的在线检测和进化培养及分选功能等,对于能够合成自身具有荧光的代谢产物的微生物及以荧光蛋白作为分子标记的基因工程菌的代谢特性研究具有平台支撑作用。
除了上述4种典型的微生物实验和微生物筛选外,MMC还可以根据使用者的自身需求,支持自定义编程多种功能,设置不同的液滴操作流程,以满足各种实验需要[17]。同时,已有的研究结果也表明,MMC可应用于多种微生物的培养研究,表现出明显优于孔板的应用成效,具有广谱适用性[18]。
液滴微流控技术因生成的液滴体积小、通量高、质能交换快、可独立操作等特性为微生物研究提供了新方法,但其操作要求高、影响因素多、缺乏自动化集成等问题限制了该技术的应用推广。本研究针对上述关键难题,通过设计开发液滴识别功能模块、液滴检测模块、进样模块以及芯片模块等,将液滴的发生、培养、检测、分割、融合、分选等多种复杂操作进行有机集成,成功研制出了一款全自动高通量微生物微液滴培养系统 (MMC),形成了小型化、自动化、高通量的微生物培养系统,并且操作简单,运行稳定。相比于传统的微生物高通量培养装备,MMC具有物料消耗少、操作简单、在线检测 (OD和荧光)、数据采集密度大、普适性强等多种优势。
目前,本研究已经完成了MMC系统底层单元操作的开发,未来需要针对微生物研究的不同需求,进一步丰富MMC系统应用功能,例如开发多因素多水平正交实验功能,多样品自动进样技术用以同时测定多个菌种的生长曲线,液滴内氧分压和pH等参数的精确控制等,全面助推微生物培养进入高通量智能化的微滴时代。
通讯作者1

主持国家自然科学基金重大仪器专项项目、中以国际合作项目。发表学术论文280余篇,合作著书8本,编写英文专著1部,译著教材2部。申请发明专利100余项,获得发明专利80余项。担任Biochemical Engineering Journal副主编及《生物工程学报》等多个国内外学术期刊编委。获得第17届全国发明展览会奖银奖 (2007)、北京市科学技术奖三等奖 (2008)、中国石油和化学工业协会技术发明奖二等奖 (2009)、中国侨界贡献奖 (创新人才) (2010)、高等学校科学研究优秀成果奖 (科学技术) 科技进步奖 二等奖 (2015年)、 第45届日内瓦国际发明展金奖 (2017)、中国化工学会系统2012–2017年度先进个人 (2017)、全国归侨侨眷先进个人 (2018)、日本东京大学工学院会士 (Fellow) 荣誉称号 (2018) 中国轻工业联合会技术发明一等奖 (2019)。
通讯作者2

主持国家自然科学基金项目、国家重点研发计划课题。在Nature Chemical Biology、Nucleic Acids Research、Metabolic Engineering等学术期刊发表多篇论文。担任中国生物发酵产业协会微生物育种分会秘书长、Carbon Resources、Food Science and Human Wellness等期刊编委。获得中国轻工业联合会技术发明一等奖 (2019)、“长江学者奖励计划”青年学者 (2018)、“伦世仪教育基金”杰出青年学者奖 (2018)、第45届日内瓦国际发明展金奖 (2017)。
·END·








